Resistencia a cotrimoxazol
La primera cepa clínica de neumococo resistente a trimetoprim-sulfametoxazol se aisló por primera vez en 1972 de un paciente con una exacerbación aguda de bronquitis crónica
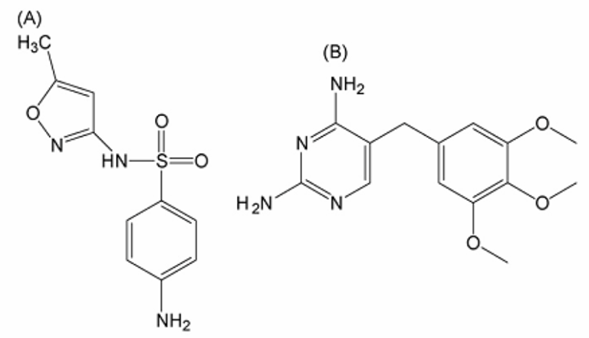
La combinación de trimetoprima con sulfametoxazol (cotrimoxazol), es un antibiótico ampliamente utilizado con un amplio espectro de actividad contra diversas infecciones bacterianas dentro de ellas las infecciones del tracto respiratorio inferior, infecciones del tracto urinario, infecciones de la piel y los tejidos blandos y las infecciones gastrointestinales
La resistencia al cotrimoxazol se asocia con la mutación en los genes folP y folA que codifican las enzimas dihidropteroato sintasa (DHPS) y dihidrofolato reductasa (DHFR), respectivamente. En los aislados resistentes al sulfametoxazol, el folP se caracteriza por una inserción de 3 o 6 pb, lo que resulta en la inserción de uno o dos aminoácidos en el sitio de unión a la sulfonamida DHPS (1).
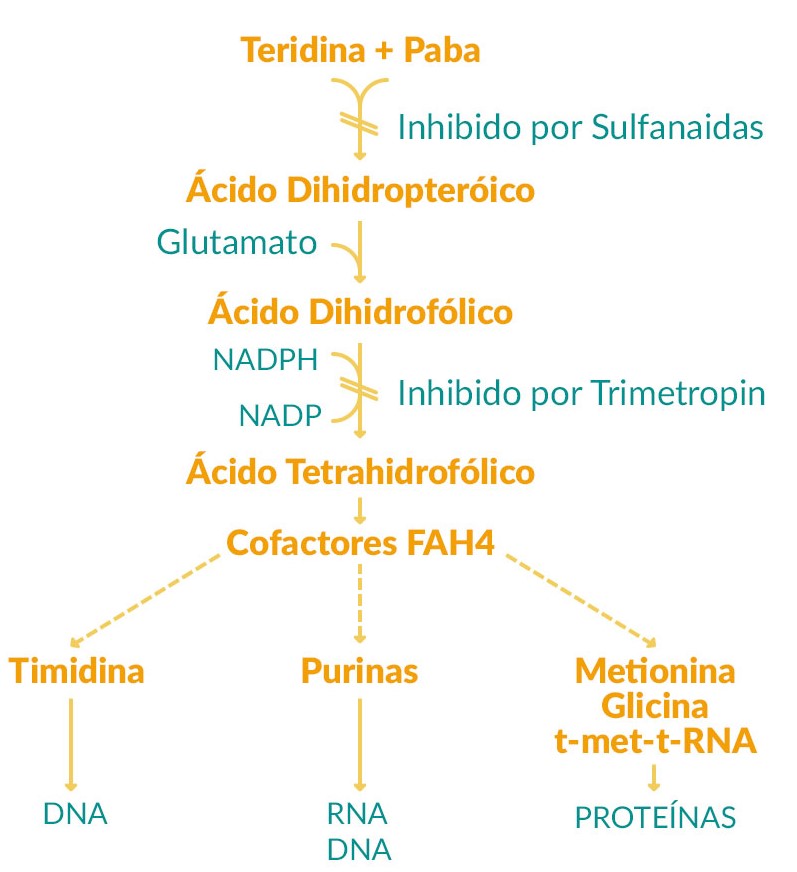
La trimetoprima y el sulfametoxazol interfieren con la biosíntesis del ácido fólico. Por su lado, la trimetoprima inhibe selectivamente la dihidrofolato reductasa bacteriana (DHFR), evitando así la reducción de dihidrofolato a tetrahidrofolato. Por su lado, el sulfametoxazol compite con el para-aminobenzoato por la dihidropteroato sintetasa (DHPS), impidiendo la producción de 7,8-dihidropteroato y, por lo tanto, deteniendo la síntesis bacteriana de ADN, ARN y proteínas, es decir. bloquean las vías metabólicas de la bacteria, lo que conduce a la muerte celular bacteriana (2).
La resistencia a la trimetoprima en aislamientos clínicos de S. pneumoniae es el resultado de una sustitución de un solo aminoácido (Ile-100 a Leu) en dihidrofolato reductasa bacteriana (DHFR) codificado cromosómicamente, donde este cambio de aminoácidos probablemente interrumpiría el enlace de hidrógeno de la DHFR al grupo 4-amino de la trimetoprima, alterando así la función de la DHFR.
Se identificó la duplicación de tres o seis bases que resulta en la repetición de uno o dos aminoácidos en la región de Arg-58 a Tyr-63 de la DHPS codificada cromosómicamente en un aislado resistente. Más recientemente, se detectó una duplicación de Ser-61, una duplicación de Arg-58 y Pro-59 y una inserción de un residuo de arginina entre Gly-60 y Ser-61 en DHPS en cepas clínicas sudafricanas de S. pneumoniae resistentes a trimetoprim-sulfametoxazol (1).
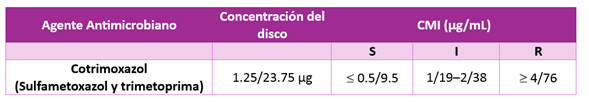
Tabla: CMI de cotrimoxazol para Streptococcus pneumoniae según CLSI (3).
Referencias
(1) Emmanuelle Charpentier ET. Mecanismos de resistencia y tolerancia a antibióticos en Streptococcus pneumoniae. En: Elsevier, editor. Sciencedirect.com [Internet]. Filadelfia, PA, Estados Unidos de América: Elsevier - Health Sciences Division; 2000 [citado el 2 de enero de 2001]. p. 1855−1864. Disponible en: https://www.sciencedirect.com/science/article/pii/S1286457900013459#BIB38.
(2) Prashant Waghchaure, Trupti Thange , Gaikwad Vishal. Basic Chemistry,Mode Of Action And Clinical Uses Of Co-Trimoxazole. INTERNATIONAL JOURNAL IN PHARMACEUTICAL SCIENCES [Internet]. 2023 [citado el 12 de agosto de 2023];1:135–49. Disponible en: https://www.ijpsjournal.com/article/Basic-Chemistry,Mode-Of-Action-And-Clinical-Uses-Of-Co-Trimoxazol.
(3) M100 Performance Standards for Antimicrobial Susceptibility Testing. Iacld.com. Recuperado a partir de: https://iacld.com/UpFiles/Documents/672a1c7c-d4ad-404e-b10e-97c19e21cdce.pdf.